

Das vergangene Jahr wurde von der Generalversammlung der UN und der UNESCO zum „Internationalen Jahres des Periodensystems“ ausgerufen. In den zugehörigen Pressetexten heben die Verantwortlichen hervor, dass der russische Chemiker Dimitrij Mendelejew der „Entdecker“ des Periodensystems sei und dabei bezieht man sich auf eine Publikation Mendelejews aus dem Jahre 1869. Die Leistungen des gebürtigen Varelers und Namensgebers unserer Schule, Julius Lothar Meyer, und anderer Forscher wurden indes nicht sichtbar gewürdigt.
In diesem Jahr ist es 150 Jahre her, dass Lothar Meyer in einer seiner bedeutsamsten Veröffentlichungen bereits 55 Elemente in einem Periodensystem anordnete. Als wesentliches Werkzeug nutzte Meyer, getreu seinem Hauptinteresse, der physikalischen Chemie, die Atomgewichte, deren präzise Ermittlung in der damaligen Zeit große Fortschritte machte. Er erkannte, dass bestimmte Eigenschaften bei größer werdendem Atomgewicht periodisch wiederkehrten.
Meyers Periodensystem von 1870 war nicht das erste und nicht das letzte in einer Reihe von Periodensystemen. So veröffentlichte Meyer bereits 1864 und 1868 zwei Periodensysteme mit einem Umfang von 28 respektive 52 Elementen. Die wichtige Wegmarke Meyers aus dem Jahre 1870 nahmen wir uns 2020 zum Anlass, diese 55 Elemente genauer anzusehen und in motivierender Weise zu präsentieren. Schülerinnen und Schüler, sowie einige Lehrerinnen und Lehrer unserer Schule haben sich zu fast allen dieser Elemente Gedanken gemacht und ganz unterschiedliche Element-Steckbriefe erstellt. 2025 wurden die Arbeitsergebnisse archiviert.
Hinweise zu den ausgegrauten Elementen:
In dem Aufsatz "Die Natur der chemischen Elemente als Funktion ihrer Atomgewichte" findet sich die folgende grafische Darstellung der Erkenntnisse Lothar Meyers:
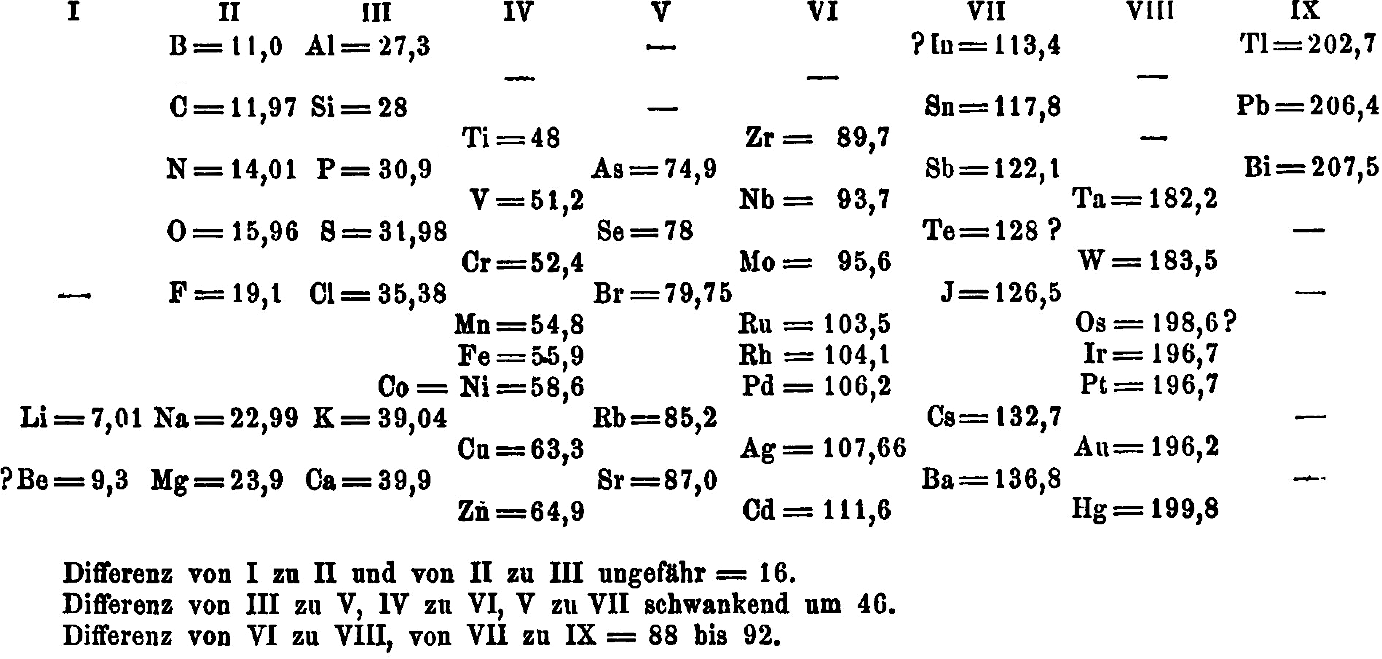
Viele Schülerinnen und Schüler, die die moderne Darstellungsweise des Periodensystems gewohnt sind, benötigen eine kurze Orientierung in diesem Periodensystem. Hier sind nämlich die Elementfamilien/Gruppen horizontal (nicht nummerierte Zeilen) und die Schalen/Perioden vertikal (mit römischen Ziffern nummerierte Spalten) angeordnet.
Die Elemente sind nach Atomgewicht sortiert (Li, Be, B, C, ...), es treten aber Ausnahmen auf: Verständlicherweise passt zum Beispiel Iod (J) besser in die Familie der Halogene als in die 6. Hauptgruppe neben Schwefel und Selen. Meyer vermutete als Ursache ungenau bestimmte Atomgewichte und vermerkte dies kritisch durch das Fragezeichen. Ob die Striche für noch nicht bekannte Elemente stehen sollten, lässt sich nicht Gewissheit sagen; immerhin sind die Lücken nach Aluminium und Silicium da. Später wurden sie mit Gallium (entdeckt 1875) und Germanium (1886) gefüllt. Mendelejew war diesbezüglich etwas mutiger und stellte 1871 Vermutungen über die Eigenschaften der noch nicht entdeckten Elemente Eka-Aluminium (= Gallium) und Eka-Aluminium (= Germanium) an.
Trotz der Ungereimtheiten bei den Nebengruppenelementen (zum Beispiel die fehlende 7. Nebengruppe für das Mangan) muss man feststellen: Vergleicht man die historische Darstellung geduldig mit der weiter oben gezeigten, modernen Form, erkennt man das schon sehr weit fortgeschrittene System.
Idee und Umsetzung: Jonas Sluiter, Fachobmann Chemie am Lothar-Meyer-Gymnasium Varel, Stand: 28.08.2020. Ich freue mich auch über kritische Anmerkungen, Fehlerhinweise etc.!